Science特刊:一文读懂经典癌症免疫疗法
▎药明康德/报道
简介:2013年,《科学》杂志评选肿瘤免疫治疗为“年度科学突破”。 在过去的5年里,我们见证了肿瘤免疫治疗领域的许多可喜进展:第一个抗PD-1疗法、第一个抗PD-L1疗法、第一个CAR-T疗法都在2018年获批上市。这段时间。 治愈的希望。 近日,《科学》杂志再次将目光投向了肿瘤免疫治疗,并推出特刊,回顾该领域的成果。 在昨天的文章中,我们将首先关注大家最熟悉的肿瘤免疫疗法——免疫检查点抑制剂。
免疫检查点是一类可以负向调节免疫活性并抑制抗肺癌疗效的分子。 通过靶向和抑制这种分子,我们在多种肿瘤类型的患者中看到了前所未有的持久缓解。 这是六年科学改造的结果。
CTLA-4抑制剂
如果免疫检查点抑制剂的发展史上有一个“决定性时刻”,相信很多人都会投票给James Allison、Jeffrey Bluestone等人的重要发现——CTLA-4。 这种蛋白的全称是细胞毒性T淋巴细胞相关蛋白-4,它可以对T细胞产生抑制作用。
这种蛋白质的作用机制很有趣。 在T细胞受体和CD28的作用下,这种原本存在于细胞内的蛋白质会与细胞表面相通,结合关键的共刺激分子CD80和CD86,解除CD28的武装,抑制T细胞的增殖和活化。 CTLA-4 对免疫系统的重要性已在大鼠模型中得到验证。 结果发现,在缺乏这些蛋白质的老鼠身上,淋巴细胞会爆发式减少,攻击老鼠几乎所有的器官,导致植物死亡。
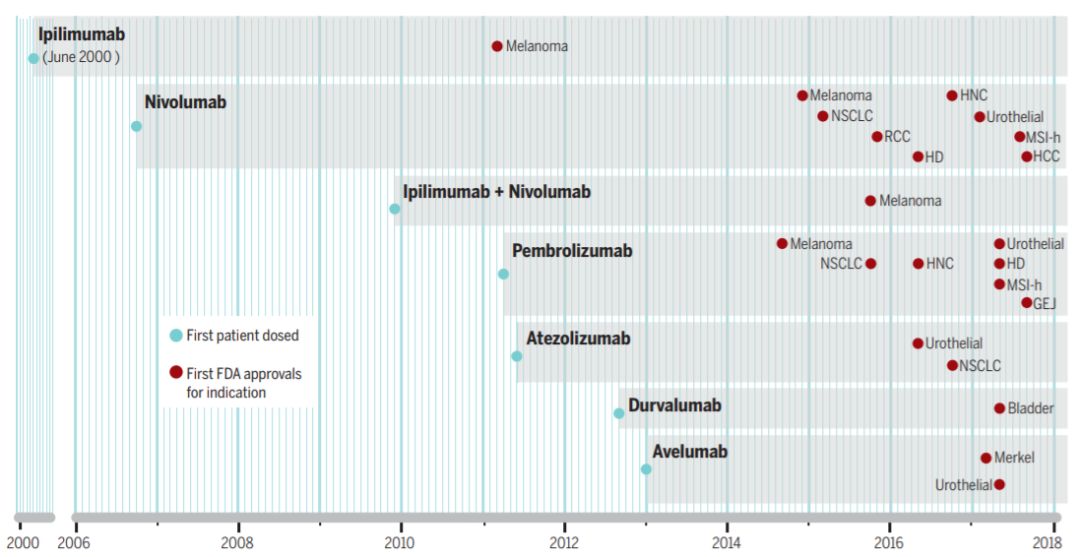
▲免疫检查点抑制剂的临床试验及获批进展(来源:《科学》)
从这一发现中,研究人员听到了实际应用的潜力:如果我们能够抑制 CTLA-4 蛋白,我们或许能够重新编程 T 细胞的活性。 在Dean James Allison等人的带领下,CTLA-4抗原在植物模型中显示出良好的抗肺癌功效,这些积极的成果也加速了CTLA-4抑制剂进入临床阶段。
2000年,有两种CTLA-4抗原进入临床试验阶段癌症免疫疗法骗局,即ipilimumab和tremelimumab。 研究人员也很快意识到,CTLA-4抗原有两个方面——一方面,它确实可以为患者带来持久的病灶消退。 晚期转移性黄色瘤患者,CTLA-4抑制剂停药后疗效可维持10年! 在两项小型 3 期临床试验中,否认 ipilimumab 是第一种与氨基酸 BCG 或标准放射疗法相比显着延长转移性黄色瘤患者生存期的疗法。 它也在2011年获得了英国FDA的批准。
但另一方面癌症免疫疗法骗局,CTLA-4的减量率比较低,副作用也比较显着。 除此之外,研究人员还在不断寻找新的免疫检查点抑制剂。
PD-1抑制剂
PD-1的全称是程序性细胞死亡1蛋白。 PD-1作为T细胞表面的一种受体,与癌细胞表面表达的PD-L1结合后,通过SHP-2蛋白使TCR下游信号分子脱乙酸,抑制抗肺T细胞的抗癌能力。 有趣的是,PD-1的免疫抑制作用主要表现在抗肺癌方面。 研究人员发现,缺乏 PD-1 的大鼠没有表现出严重的自身免疫反应。 因此,与CTLA-4抑制剂相比,PD-1抑制剂的临床潜力更为广阔。
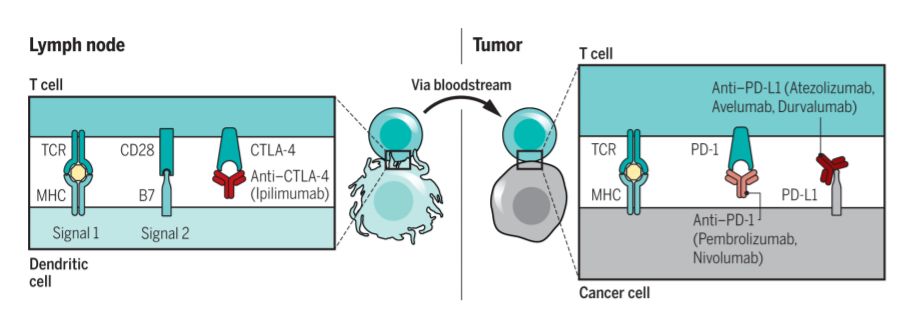
▲CTLA-4和PD-1抑制剂的作用机制(来源:《科学》)
第一个被否认具有抗肺癌潜力的 PD-1 抑制剂是百时美施贵宝 (Bristol-Myers Squibb) 带来的纳武单抗 (nivolumab)。 早在2006年,它就完成了第一位患者的治疗。 在患有红细胞瘤、肾细胞癌和非小细胞白血病的患者中,nivolumab 表现出令人印象深刻的客观反应率和有限的副作用。 这一初步试验的结果极大地鼓舞了开发者的积极性,带动了临床管线的快速发展。
目前,已有5个靶向PD-1/PD-L1的抗原获得英国FDA批准上市。 它们是针对PD-1的pembrolizumab和nivolumab,以及针对PD-L1的atezolizumab、avelumab和durvalumab。 它们除了在各自疾病领域取得突破性疗效外,也成为首个不针对肿瘤部位,而是针对特定基因特征的疗法,是精准医疗时代的最佳案例之一。
随着大量临床数据的发布,研究人员也已经能够剖析出最能从 PD-1 抑制剂治疗中获益的疾病类型。 目前,霍奇金淋巴瘤、默克尔细胞癌、微卫星不稳定/错配修复缺陷病、成人灰色黑色素瘤是PD-1抑制剂大显身手的主战场,减幅可达50%-90%。 致畸剂诱发的红色黑色素瘤也是PD-1抑制剂可以发挥重要作用的领域,减少率达35%-40%。 例如非小细胞白血病、头颈癌、胃癌、膀胱癌等疾病,降低幅度在15%-25%。

▲PD-1抑制剂在不同疾病中的客观缓解率(来源:《科学》)
与常见的抗癌靶向治疗不同,PD-1/PD-L1抑制剂一旦缓解症状,这种作用往往能持续很长时间,而且疾病的恶变率也较低。 这是因为 T 细胞可以“记住”癌细胞的样子。 许多人认为,PD-1疗法的开发是癌症预防史上的一个重大里程碑。
抗PD-1治疗耐药
也有大量临床数据支持,人们对抗PD-1疗法的作用机制有了更深入的认识。 我们发现大部分在接受PD-1抑制剂或PD-L1抑制剂单药治疗后病情得到缓解的患者,T细胞在诊治前就具有抗肺癌活性。 然而,这种浸润性T细胞识别出病变抗体后,会启动PD-1的表达并释放IFN-g,导致肿瘤细胞表达PD-L1,让T细胞放下装备停止攻击。 这个过程也被称为适应性免疫耐受(adaptiveimmuneresistance)。 因此,抑制PD-1/PD-L1通路可以有效恢复免疫对癌症的杀伤能力。
但对于缺乏T细胞浸润的癌症,抗PD-1疗法的疗效并不是很突出。 已发现T细胞浸润不足的原因有很多:第一个原因是病变带来的突变不足以形成新的可识别抗体,因此免疫原性不足; 另一个原因是病变对T细胞的排除有积极作用。 深入挖掘,潜在的生物学机制更加复杂——基因表达、其他免疫检查点的抑制、免疫抑制细胞和癌症微环境都会产生影响。

▲了解PD-1抑制剂的作用机制有望帮助理解其耐药性(来源:《科学》)
尽管癌症的免疫原性可以触发特定的 T 细胞反应,但癌细胞并不会孤立无援。 它们经历了一系列涉及遗传和非遗传物质的修饰,以防止它们被免疫系统消灭。 这个过程也被称为肿瘤的癌症免疫编辑。 其后果是多种多样的:癌细胞可以改变基因,从而抑制最具免疫原性的突变,或者参与抗体呈递的基因被下调。 这将导致对 PD-1 抑制剂产生耐药性。
我们现在知道 JAK1/2 的基因失活可能是肿瘤免疫编辑的产物。 在 IFN-g 受体通路中,JAK1 和 JAK2 是信号传递的关键。 只要缺少一个基因,信号就不能顺利传递,导致癌细胞无法表达PD-L1,导致PD-1/PD-L1通路抑制剂失效。 这已在 JAK1/2 基因完全失活的患者中得到证实。
上述发现告诉我们,抗PD-1治疗耐药的原因范围很广,仅靠单一生物标志物筛选患者可能还不够。 因此,建议考虑 DNA 分析(胃癌突变负荷或关键免疫通路突变)、RNA 分析(IFN-g 信号通路的表达、病变表型)和形态学分析(CD8 阴性 T 细胞)的结果位置、肿瘤微环境)。 现在,我们做得还不够。
与免疫检查点抑制剂联合治疗
作为最早的两类免疫检查点抑制剂,抗CTLA-4疗法和抗PD-1疗法早在2009年就迎来了首次联合——研究人员将ipilimumab与nivolumab同时给予患者。 后续结果表明,这两种抗生素联合使用可以协同发挥作用,也成为2015年获批上市的首个免疫检查点抑制剂联合疗法。
这种联合治疗的机制有望给研究人员带来启示——CTLA-4主要与引流淋巴结中的抑制性串扰有关,而PD-1/PD-L1主要集中在微观病灶。 据悉,James Allison院士课题组近期的研究也发现,抑制CTLA-4和PD-1会带来不同的T细胞表型特征。 通过结合不同的作用机制,免疫检查点抑制剂疗法有望发挥更大的潜力。
目前正在进行大量临床试验: 正在根据原发性和适应性耐药机制寻找潜在的新组合; 正在开发 TLR 激动剂和溶瘤病毒,以解决乳腺癌中低 T 细胞浸润的问题; 改善癌症微环境; 为了防止T细胞被病变主动排除,IDO成为热门靶点; 针对调节性 T 细胞和巨噬细胞的疗法也正在开发中……

这是一个癌症免疫治疗步入井喷的时代。 基于免疫检查点抑制剂的联合疗法,在这个广阔的世界里有足够的空间施展拳脚。 未来的局限不再是缺乏创新的治疗方案,而是我们能否招募到足够多的患者,启动足够多的临床试验,来回答我们在爆发式下降下真正想回答的问题。 这些问题的答案是真正成功的关键。
注:题图来自123RF
参考:
[1] 使用检查点封锁的癌症免疫疗法


